

zum Artikel

zum Artikel

zum Artikel

zum Artikel

zum Artikel

zum Artikel

zum Artikel
gesundheit-hören: Podcast-Tipps

zum Artikel

zum Artikel

zum Artikel
Ratgeber zu Krankheiten & Symptomen

zum Artikel
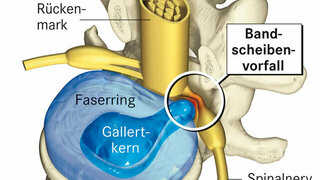
zum Artikel
zum Artikel
"Senioren Ratgeber" - aktuelle Beiträge

zum Artikel

zum Artikel

zum Artikel
"Diabetes Ratgeber" - aktuelle Beiträge
zum Artikel

zum Artikel

zum Artikel
Informationen in Einfacher Sprache
zum Artikel
zum Artikel
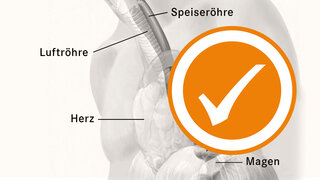
zum Artikel
Die aktuelle Apotheken Umschau
Jetzt in Ihrer Apotheke
Haben Sie gewonnen?
Hier finden Sie alle Preisrätsel-Gewinner aus der "Apotheken Umschau"

zum Artikel

zum Artikel

zum Artikel
Unsere Services

zum Artikel

zum Artikel

zum Artikel

zum Artikel
zum Artikel

zum Artikel











